Mehr als 150 Journalistinnen und Journalisten berichten rund um die Uhr für Sie über das Geschehen in Deutschland und der Welt.
Zum journalistischen Leitbild von t-online.Fragwürdige Zulassungspraxis Teurer als Gold: Dieses Medikament kostet 2.127 Euro pro Tablette


Die Hoffnung mancher Multiple-Sklerose-Patienten ist
Inhaltsverzeichnis
- Leukämie-Mittel zeigt weiteren Nutzen
- Hoffnung: Tabletten statt intravenöser Mittel
- 2010: Merck freut sich zu früh
- Merck gibt 2011 Zulassung nur scheinbar auf
- 2017 kommt Zulassung: 2.663 Euro pro Tablette
- Bundesausschuss sah keinen Zusatznutzen
- Vier von zehn Studien-Autoren mit Merck-Historie
- Europäische Agentur: signifikant erhöhte Krebsgefahr
- Was steht im Protokoll zur Zulassung?
- Langes Warten auf Ergebnisse "unvernünftig"?
- Und was ist mit Hirnentzündung PML?
- Weitere Therapie nach vier Jahren ist unklar
- Patientin in der Abwägung verloren
- Klinik-Direktor im Expertenrat von Merck
- Geld an MS-Bundesverband und deren Autor
- Lobbycontrol warnt vor Vertrauensverlust
- Patientin Schmidt nimmt es doch nicht
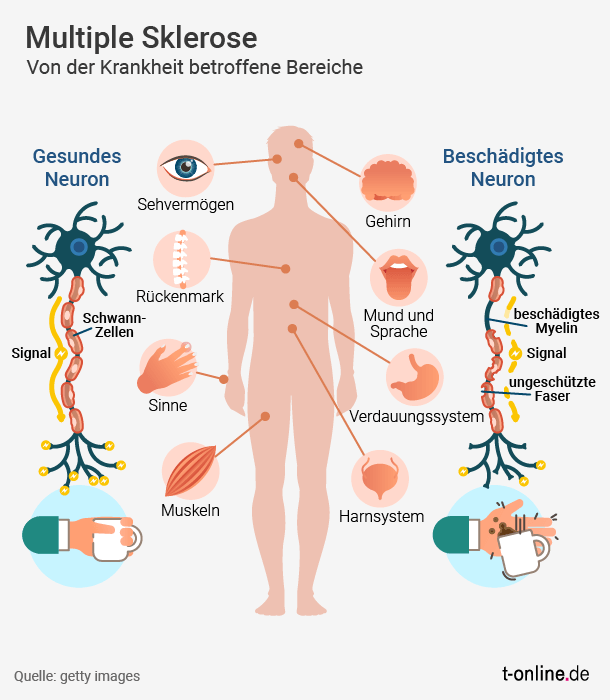
Soll sie es nehmen, das neue Medikament? Mavenclad könnte Sabine Schmidt (Name geändert) helfen. Die Mittfünfzigerin weiß seit 2000, dass sie an Multipler Sklerose erkrankt ist. Die Krankheit ist heimtückisch. Entzündungen im Gehirn und im Rückenmark haben körperliche Störungen und Ausfälle zur Folge. Erinnerungslücken kommen hinzu, eingeschränkte Aufmerksamkeit oder Orientierungslosigkeit. Viele Betroffene leiden auch unter Lähmungserscheinungen, Sehstörungen, Erschöpfung und Depressionen. Sabine Schmidt ist eine von rund 240.000 Betroffenen in Deutschland. Die Krankheit ist nicht heilbar.
Mavenclad mit dem Wirkstoff Cladribin ist da eine große Hoffnung für viele Patienten. Doch hinter dieser Hoffnung stehen viele Fragezeichen: Der Darmstädter Pharmakonzern Merck hatte die Zulassung des Mittels eigentlich bereits offiziell aufgegeben. Der Grund: Die Behörden hatten eine erhöhte Krebsgefahr bei der Einnahme befürchtet. Davon gehen sie weiter aus – und haben das Mittel dennoch zugelassen.
t-online.de zeichnet den Weg der Zulassung nach: Wie im Spannungsfeld von verzweifelten Patienten, Unternehmen unter Druck, Wissenschaftlern mit großer Nähe zu Pharmakonzernen und undurchsichtigen Prozessen ein Medikament zu einem Preis auf den Markt kommen kann, den der Hersteller zunächst sogar selbst bestimmt.
Sabine Schmidt ist seit vielen Jahren auf Medikamente gegen Multiple Sklerose angewiesen. Nicht alle Arzneimittel hat sie gut vertragen. Bei anderen zeigte sich nicht die gewünschte nachhaltige Wirkung. Zuletzt nahm sie zwei Jahre ein Medikament, das zu einer schweren Hirninfektion führen kann. "Meine Werte hatten sich zuletzt stark verschlechtert", sagte Schmidt zu t-online.de. Menschen wie sie sind auf die Entwicklung neuer Medikamente angewiesen.
Leukämie-Mittel zeigt weiteren Nutzen
Diese Forschung ist sehr aufwendig. Auf ein einziges erfolgreich auf den Markt gebrachtes Mittel kommen Tausende Substanzen, die getestet und wieder verworfen wurden. Im Schnitt braucht ein Pharmaunternehmen dafür mehr als zwölf Jahre. Und das hat seinen Preis: Die Entwicklung eines Medikaments kostet den Verband forschender Arzneimittelhersteller zufolge zwischen 970 Millionen und 2,7 Milliarden Dollar. Andere Experten sprechen auch von deutlich niedrigeren Zahlen.
In jedem Fall ist der Druck gewaltig, immer wieder einen Durchbruch zu erzielen. In der Forschungsabteilung von Merck dürfte die Freude deshalb groß gewesen sein, als die Wissenschaftler bei einem bereits eingesetzten Krebsmittel noch auf eine andere Wirkung stießen: Cladribin, Wirkstoff in einem Präparat gegen Haarzellleukämie, schlägt auch bei bestimmten Formen von Multipler Sklerose an. Bei einem Teil der Patienten vermindert es die Häufigkeit von Schüben und die Krankheit verschlimmert sich nicht weiter. Heilen kann es die Krankheit nicht.
Hoffnung: Tabletten statt intravenöser Mittel
Die Entwicklung von Movectro, so der zuerst geplante Name des MS-Medikaments, bedeutet damals eine kleine Revolution. Es muss den Patienten nicht wie viele andere Mittel in die Vene verabreicht werden, sie können es als Tablette schlucken. Zudem muss das Medikament in den ersten beiden Jahren der Behandlung nur jeweils maximal an 10 Tagen eingenommen werden. In den beiden folgenden Jahren ist gar keine Tablette nötig.
"Vor den Tabletten musste man die Medikamente und Spritzen immer mit sich führen, je nach Medikament in einer Kühlbox", erklärt Bernd Meixner von der Initiative Selbsthilfe Multiple Sklerose Kranker e. V. (MSK). Es kam sehr häufig auch zu Hautreaktionen an den Einstichstellen, wie starken Rötungen und Bildung von Quaddeln. Auch grippeähnliche Symptome nach dem Spritzen waren oft eine unangenehme Nebenwirkung.
Jetzt die Medikamente oral einnehmen zu können, "das haben viele als Segen und Erhöhung der Lebensqualität gesehen", so der MSK-Vorsitzende. Andere Pharmahersteller wollten mit MS-Tabletten diese Entwicklung nicht verpassen. So bemühte sich auch der Schweizer Pharmariese Novartis um eine Zulassung für das Präparat Gilenya. Auf dem Milliardenmarkt beginnt damals ein Kopf-an-Kopf-Rennen mit ungewissem Ausgang.
2010: Merck freut sich zu früh
Merck sieht zunächst wie der sichere Sieger aus. 2009 reicht das Unternehmen Zulassungsanträge ein bei der Europäischen Arzneimittel-Agentur (EMA) und der US-amerikanischen Food and Drug Administration (FDA). Die Behörden müssen ihr Einverständnis geben, bevor ein Medikament für den jeweiligen Markt zugelassen werden kann. Doch bei Merck herrscht Zuversicht. Denn 2010 lassen Russland und Australien das Medikament zu.
2011 folgt der Schock: Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur gibt unerwartet eine negative Stellungnahme ab. Die Behörde sieht eine erhöhte Krebsgefahr bei der Einnahme. Auch die US-amerikanische FDA will vor einer Zulassung weitere Analysen und Studien sehen. Merck zieht daraufhin seine Anträge zurück und nimmt das Präparat auch in Australien und Russland wieder vom Markt. Schließlich bekommt auch noch Rivale Novartis grünes Licht für das Konkurrenzprodukt Gilenya in Europa und den USA.
Merck gibt 2011 Zulassung nur scheinbar auf
Während der Aktienkurs von Merck angesichts der unerwarteten Entwicklung abrutscht, erklärt Merck per Pressemitteilung, den Zulassungsprozess nicht weiterzuverfolgen. Das Risiko sei "signifikant, dass selbst ein neues Programm die erforderlichen Daten für eine Zulassung von Cladribin-Tabletten nicht erbringen würde".
Doch das ist nicht so endgültig, wie es klingt. Im Hintergrund laufen Forschung und der Kampf um die Zulassung weiter. So stellt das Unternehmen auch in einem Schreiben an die EMA klar, man behalte sich vor, zu einem späteren Zeitpunkt eine Lizenz für ein anderes Medikament mit dem Wirkstoff Cladribin zu beantragen.
2017 kommt Zulassung: 2.663 Euro pro Tablette
2017 ist es dann geschafft. Merck hat ein MS-Medikament mit dem Movectro-Wirkstoff Cladribin zur Prüfung eingereicht. Und zur Verwunderung vieler Experten für Multiple Sklerose gibt die Europäische Arzneimittel-Agentur diesmal eine positive Stellungnahme für das Medikament ab, das nun Mavenclad heißt.
Und so ist Mavenclad seither auch in Deutschland erhältlich. Eine einzige 10 Milligramm-Tablette kostet zu diesem Zeitpunkt 2.663 Euro. Pro Kilogramm Körpergewicht sind 3,5 Milligramm des Wirkstoffs Cladribin nötig. Ein 80 Kilogramm schwerer Mann benötigt im ersten und zweiten Behandlungsjahr mit Mavenclad entsprechend 28 Tabletten.
Seine Behandlung kostet in den ersten beiden Jahren somit insgesamt 74.500 Euro. In den Jahren drei und vier werden keine Tabletten benötigt. Damit ist das Medikament bei zwei Behandlungszyklen etwa ein Drittel teurer als das vergleichbare Präparat Gilenya. Das ebenfalls mittlerweile erhältliche Tecfidera kostet gar nur die Hälfte.
Den Preis hat Merck Serono zunächst selbst festgesetzt. Vom Gesetzgeber ist das im meist einjährigen Prüfungszeitraum durch den Gemeinsamen Bundesausschuss (G-BA) nach der Zulassung so vorgesehen. Die Krankenkassen müssen diesen Preis zahlen, wenn ein Arzt das Mittel verschreibt. Erst nach der Prüfung durch den G-BA kann der Spitzenverband der gesetzlichen Krankenkassen den anschließenden Preis mit festlegen.
Das ist mittlerweile geschehen, ohne dass sich am Preis viel geändert hat. Seit Februar 2019 liegen die Jahrestherapiekosten laut G-BA bei Cladribin nun in den ersten beiden Jahren bei jeweils knapp 35.000 Euro. Die Jahrestherapiekosten für eine sogenannte zweckmäßige Vergleichstherapie mit dem Präparat Glatirameracetat gibt der Ausschuss mit 11.263,55 Euro an.
Bundesausschuss sah keinen Zusatznutzen
Zudem hatten die für die G-BA-Prüfung zuständigen Experten vom Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG) bereits Anfang 2018 geurteilt, dass im Vergleich zu bereits bestehenden Therapien für Mavenclad "ein Zusatznutzen nicht belegt" ist. Und zwar in keinem der geprüften Punkte.
Merck hält auf Nachfrage von t-online.de dagegen, man teile die Einschätzung nicht und sehe in Mavenclad einen deutlichen Mehrwert für Patienten, Ärzte und Gesundheitswesen: "Die europäischen Leitlinien, an deren Erstellung renommierte deutsche MS-Experten beteiligt waren, haben Mavenclad direkt als relevante Therapieoption für (hoch-)aktive schubförmige MS aufgenommen", so das Unternehmen. Die Bedeutung in der Therapie spiegele sich auch im Preis wider, er stelle einen angemessenen Interessenausgleich dar, so Merck.
Der Gemeinsame Bundesausschuss hatte im Verfahren eine von Merck vorgelegte Studie links liegen gelassen, wonach Mavenclad im Vergleich mit anderen Medikamenten eine wirksame und sichere Alternative sei. "Es wird ausschließlich auf Vorteile eingegangen und Nachteile bleiben unerwähnt", teilte eine Sprecherin des Ausschusses t-online.de mit. Die Analyse sei zudem nicht geeignet, weitere Fragestellungen des G-BA zu beantworten. Mehrere Autoren der Studie hatten direkt für das Unternehmen gearbeitet, eine Person hat sogar Aktienbeteiligungen.
Vier von zehn Studien-Autoren mit Merck-Historie
Es ist bereits die zweite von Merck eingereichte Studie, in der die Neutralität der Autoren in Frage steht. Denn auch im Oktober 2015, als die Zulassung unerreichbar schien, hatten Forscher eine Studie zum Wirkstoff Cladribin veröffentlicht. Darin kommen sie zu einem überraschenden Ergebnis: Anders als die Experten bei der EMA und der US-amerikanischen FDA sehen sie keinen Beleg, dass Cladribin zu einer erhöhten Krebsrate bei Multiple-Sklerose-Patienten führt.
Das war der Moment, in dem Merck Hoffnung schöpfte. Auf Anfrage von t-online.de teilt das Unternehmen mit: "Die Arbeit bestätigt das günstige Sicherheitsprofil von Mavenclad und war unter anderem die Grundlage für eine erneute Einreichung bei den Behörden – neben zahlreichen Anfragen von Ärzten und Patienten."
Doch bei der Studie fällt auf: Vier der zehn an der Studie beteiligten Forscher und Forscherinnen waren in der Vergangenheit für Merck tätig. Einer hat im wissenschaftlichen Beirat des Unternehmens gesessen, ein weiterer als Berater für den Pharmakonzern gearbeitet. Und eine an der Studie beteiligte Medizinerin hat Forschungsgelder erhalten. Ein Forscher hat sogar ein eigenes Patent eingereicht für die Behandlung von Multipler Sklerose mit eben jenem Wirkstoff Cladribin.
Wie unabhängig arbeiten Forscher, wenn sie selbst derart klar von einer Marktzulassung profitieren? Merck möchte sich nicht äußern, wie sich diese Interessenkonflikte auf die Ergebnisse der Studie ausgewirkt haben könnten.
Christiane Fischer von MEZIS, der Initiative unbestechlicher Ärztinnen und Ärzte, hat eine klare Meinung: "Natürlich arbeiten Forscher und Forscherinnen niemals unabhängig, wenn sie von der Marktzulassung selbst profitieren, also einen handfesten Interessenkonflikt haben." Es gebe sehr viele internationale Belege dafür, dass dies Ergebnisse verfälschen könne. "Daher denken wir, dass Forscherinnen und Forscher bei Interessenkonflikten nicht in dem Bereich forschen und abstimmen sollten", so die Ärztliche Geschäftsführerin von MEZIS.
Europäische Agentur: signifikant erhöhte Krebsgefahr
Die Europäische Arzneimittel-Agentur räumt auf Anfrage von t-online.de ein, besagte Studie bei ihrer späteren Neubewertung tatsächlich zurate gezogen zu haben. Die Studie habe aber die beobachteten Krebserkrankungen nicht völlig erklären können. Und auch, wenn diese Studie nur eine von vielen konsultierten ist, bleiben viele Fragen offen.
Denn in ihrer abschließenden Stellungnahme erklärt die EMA, dass sie weiter von einer signifikant erhöhten Krebsgefahr bei Einnahme des Medikamentes ausgeht. In den klinischen Studien seien bei den mit Cladribin behandelten Patienten bis zu dreimal häufiger Tumore aufgetreten als bei Patienten in der Vergleichsgruppe, die ein Placebo erhielten.
Hersteller Merck sieht das anders. Das Unternehmen teilt t-online.de mit, die Datenlage sei deutlich umfangreicher als bei der ersten Einreichung 2009. "Es gibt laut diesen Daten kein erhöhtes Risiko für eine Krebserkrankung unter Mavenclad im Vergleich zu anderen krankheitsmodifizierenden Medikamenten sowie im Vergleich zur Allgemeinbevölkerung."
Die Aussage des Herstellers steht gegen die Einschätzung der Experten von der Europäischen Arzneimittel-Agentur. Und auch Jutta Scheiderbauer, selbst von Multipler Sklerose betroffene Ärztin und Vorstandsmitglied der MS-Stiftung Trier, widerspricht Merck: Es seien lediglich Teilnehmer der ersten Studie in eine weiterführende Studie übernommen worden.
Jeder dieser Patienten habe irgendwann Cladribin bekommen. Es gebe also keine Placebo-Vergleichsgruppe. Scheiderbauer: "Im Vergleich zur Allgemeinbevölkerung kann man entsprechend aus den Daten nichts herauslesen."
Was steht im Protokoll zur Zulassung?
Auch das unabhängige Fachmagazin "arznei-telegramm" urteilt insgesamt negativ über Mavenclad. Cladribin berge erhebliche Sicherheitsrisiken, so die Experten. "Der Zulassungsantrag hätte erneut wegen Sicherheitsbedenken abgelehnt werden müssen." Und weiter: "Wir raten von Cladribin zur Behandlung ab."
Im Protokoll der Entscheidungsfindung bei der Europäischen Arzneimittel-Agentur ließe sich nachvollziehen, wie die Zulassung zustande kam. Doch die EMA will das Dokument t-online.de nicht herausgeben. Sie verweist lediglich auf eine Zusammenfassung, aus der diese Informationen nicht hervorgehen. Auf Nachfrage teilt die Agentur mit, die Zulassung sei diesmal erfolgt, weil aufgrund zusätzlicher Studien der Nutzen klarer dargestellt sei. Nutzen und Risiko würden nun in einem anderen Verhältnis stehen.
Doch das Risiko ist bei einem Mittel wie Mavenclad noch gar nicht wirklich absehbar: Der Beobachtungszeitraum war kurz. Und das Krebsrisiko bei der Einnahme zytostatischer Medikamente wie Mavenclad, die das Zellwachstum hemmen, ist teilweise erst nach 10 bis 20 Jahren klar. Man weiß also heute noch gar nicht, ob das Risiko nicht deutlich höher ist, als die Kurzzeitstudie zeigt.
Langes Warten auf Ergebnisse "unvernünftig"?
"Cladribin kann von allen Körperzellen aufgenommen und in die DNA sich teilender Zellen eingebaut werden", erklärt MS-Expertin Jutta Scheiderbauer. Dabei komme es zu Fehlern im Ablesen der DNA und in der Folge zum Absterben der Zellen. "Überlebende Zellen können eventuell Mutationen behalten, was zur Entstehung von Tumoren führen kann. Diese Effekte können, wenn Cladribin erst einmal eingenommen wurde, im Nachhinein nicht mehr rückgängig gemacht werden."
Die Arzneimittelprüfer der Europäischen Arzneimittel-Agentur befinden sich in einem Dilemma: Blockade möglichen medizinischen Fortschritts einerseits, Unsicherheit über nicht erforschte Langzeitwirkungen andererseits. Es sei aber "unvernünftig", bei Medikamenten mit erhöhtem Krebsrisiko 20 Jahre mit einer Zulassung zu warten, so die EMA.
Doch welche Folgen derartige Entscheidungen haben können, zeigt der Fall eines weiteren Multiple-Sklerose-Medikaments. Das 2016 zugelassene Zinbryta führt zu schwerwiegenden Lebererkrankungen und Gehirnentzündungen. Eine Patientin in Deutschland starb sogar nach der Behandlung. Der Hersteller hat das Präparat im März 2018 wieder vom Markt genommen. Unabhängige Experten wie das "arznei-telegramm" hatten auch bei Zynbrita "wegen erheblicher Sicherheitsprobleme" vor der Einnahme gewarnt.
Und was ist mit Hirnentzündung PML?
Nicht nur die erhöhte Krebsgefahr treibt Experten um. Beim ursprünglichen Einsatz von Cladribin gegen Haarzell-Leukämie traten zudem mehrfach Fälle einer seltenen Hirnentzündung auf, der progressiven multifokalen Leukenzephalopathie (PML). Und dort ist die Cladribin-Dosis noch bedeutend geringer als in Mavenclad.
Mavenclad-Hersteller Merck teilt mit, im klinischen Studienprogramm und auch in der realen Behandlungssituation nach Zulassung sei bisher kein PML-Fall berichtet worden. Mit solchen Fällen sei aber auch Jahre nach Absetzen des Mittels noch zu rechnen, warnt das Fachmagazin "arznei-telegramm".
Weitere Therapie nach vier Jahren ist unklar
Dieses PML-Risiko hat die EMA nach eigener Darstellung berücksichtigt: Merck sei verpflichtet worden, es im Rahmen weiterer Studien zu beobachten. Ausreichende Gründe für ein Aussetzen oder Verweigern der Zulassung sah man dort aber deswegen nicht.
Irritierend ist aber auch: Es ist offenbar unklar, wie die weitere Behandlung nach einem Zyklus aussieht. Wie geht es weiter, wenn ein Patient zwei Jahre Mavenclad genommen und dann wie vorgesehen zwei Jahren ausgesetzt hat? Merck beantwortet die Frage nicht und teilt lediglich mit, es seien keine klinischen Studien durchgeführt worden, um den Einsatz von Mavenclad jenseits dieses Vier-Jahres-Zeitraums zu untersuchen. Und die Europäische Arzneimittel-Agentur stellt lediglich fest: "Eine Wiederaufnahme der Therapie nach dem vierten Jahr wurde nicht untersucht."
Patientin in der Abwägung verloren
Eine schwierige Situation für die Patienten, die auf Medikamente angewiesen sind. Sabine Schmidt hat sich deshalb gleich bei drei renommierten Ärzten Rat eingeholt, sagte sie t-online.de. "Zwei der drei Ärzte haben mir geraten, die Krankheit künftig entweder mit Mavenclad oder mit Ocrevus zu behandeln." Aufgrund der jeweils zu erwartenden Nebenwirkungen habe sie zunächst erwogen, Mavenclad zu nehmen. Doch dann geriet sie ins Wanken.
Sabine Schmidt fühlte sich verloren bei der Abwägung: "Ich habe riesige Angst vor dieser Entscheidung. Ich habe mir zu Hause eine Liste mit allen in Frage kommenden Medikamenten und deren möglichen Nebenwirkungen gemacht."
Das Mittel, das sie zuletzt genommen hatte, hatte den sogenannten JCV-Antikörper-Index schnell ansteigen lassen. Das birgt die Gefahr der schweren Hirnentzündung (PML), die tödlich verlaufen kann. Die mögliche Krebsgefahr bei Mavenclad erschien ihr zunächst wie das kleinere Übel.
Klinik-Direktor im Expertenrat von Merck
Patienten sind entsprechend darauf angewiesen, von Medizinern unabhängig beraten zu werden. Von Ärzten wie etwa Professor Christoph Kleinschnitz, Direktor der Klinik für Neurologie an der Uniklinik Essen, der die Behandlung von Patienten mit Multipler Sklerose zu seinen Schwerpunkten zählt. Zugleich ist er Mitglied im sogenannten Mavenclad-Expertenrat des Herstellers Merck. Dort berät er Ärzte* zur Therapie mit Mavenclad. Der Service erscheint gut, Rückruf wird garantiert.
t-online.de will von dem Experten wissen, wie sich diese von Merck organisierte Tätigkeit mit einer neutralen Beratung verträgt. Und seit wann er Mitglied des Expertenrats ist. Doch der Direktor der Klinik für Neurologie möchte weder mit t-online.de sprechen, noch die Fragen schriftlich beantworten. Er möchte auch nicht sagen, wie häufig er Patienten bislang Mavenclad verschrieben hat.
Allgemein bekannt ist nur, dass das Medikament allein in Deutschland seit Markteinführung am 15. September 2017 bis einschließlich des ersten Halbjahres 2018 mit einem Brutto-Volumen von rund 25 Millionen Euro zu Lasten der gesetzlichen Krankenversicherung verordnet und erstattet wurde.
Auch Hersteller Merck möchte unter Verweis auf Datenschutz nicht mitteilen, wie viel Kleinschnitz und andere Ärzte detailliert für diese Tätigkeit erhalten haben. Einige Zahlen können jedoch in der Datenbank "Euros für Ärzte" recherchiert werden: Kleinschnitz hat dieser zufolge alleine 2016 Zuwendungen in Höhe von 65.053 Euro von der Pharmaindustrie erhalten. Davon entfällt weit über ein Drittel auf Gelder von Merck. Das Unternehmen zahlte dem Arzt allein 4.729,50 Euro für Spesen. Unterlagen von Merck zufolge stieg die Summe im Jahr 2017 auf 34.488,15 Euro für Honorare und 3.632,88 für Auslagen. Kleinschnitz lässt offen, ob Angestellte oder die Klinik zusätzlich Geld erhalten haben und wie viel er 2018 für seine Tätigkeit erhalten hat.
Geld an MS-Bundesverband und deren Autor
Und Merck bezahlt nicht nur Ärzte. Mehr als 100.000 Euro hat Merck 2018 an diverse Beratungsstellen rund um die Krankheit gespendet, die Patienten professionell zu geeigneten Medikamenten informieren sollen. Allein 41.650 Euro gingen an die Deutsche Multiple Sklerose Gesellschaft (DMSG). Eben jene Gesellschaft hat ein Handbuch zu Mavenclad herausgegeben und schreibt: "Statistisch gesehen traten die Krebserkrankungen bei Cladribin-Tabletten-Einnahme nicht gehäuft auf." Ein Widerspruch zu den Ergebnissen der Experten bei der EMA?
Die DMSG weist das zurück. "Alle Fälle von Krebs sind in der Patienteninformation erwähnt. Diese Häufungen sind aber eben nicht statistisch belastbar, weswegen auch die Formulierung 'Statistisch gesehen nicht gehäuft auf' gewählt wurde", so Christoph Heesen, federführender Autor. Deshalb habe man auch geschrieben, dass alle Medikamente, die das Immunsystem beeinflussen, das Krebsrisiko erhöhen können.
Heesen leitet am Universitätsklinikum Hamburg-Eppendorf die MS-Ambulanz. Auch er erhielt Geld von Merck. 2016 beispielsweise 4.476,78 Euro für Honorare, 464,50 Euro für Spesen und 400 Euro für Tagungsgebühren. Wofür genau das Geld floss, möchte er t-online.de nicht erklären. Auch nicht, wie viel Geld er oder die MS-Ambulanz in den darauffolgenden Jahren von Merck erhielten.
Wir weisen den Mediziner auf Studien hin, wonach Zahlungen der Pharmaindustrie zu einem veränderten Verschreibungsverhalten der Ärzte führen. Doch auch dazu möchte Heesen sich nicht äußern.
Lobbycontrol warnt vor Vertrauensverlust
Lobbycontrol, eine unabhängige Initiative für Transparenz und Demokratie, sieht derartige Verhaltensweisen kritisch: "Natürlich ist Pharmaunternehmen daran gelegen, ihre Produkte anzupreisen. Finanzielle Verflechtungen mit Ärzten oder eigentlich unabhängigen Beratungseinrichtungen beschädigen aber das Vertrauen der Menschen in diesem wichtigen Bereich."
Interessenkonflikte seien daher unbedingt zu vermeiden. "Insgesamt brauchen wir noch deutlich mehr Transparenz darüber, wer wen im Medizinbereich für was bezahlt", so der gemeinnützige Verein.
Weltweit hat Mavenclad dem Hersteller im vergangenen Jahr 90 Millionen Euro eingebracht und damit erheblich zum Wachstum beigetragen. 2019 rechnet das Unternehmen bereits mit einem dreistelligen Millionenumsatz.
Patientin Schmidt nimmt es doch nicht
Sabine Schmidt wollte eigentlich in diesen Tagen mit der Einnahme von Mavenclad beginnen. Nach der Entnahme von Rückenmarksflüssigkeit ergab die Untersuchung, dass sie sich zumindest wegen PML wenig Sorgen machen müsste. Die dafür maßgeblichen Werte haben sich deutlich gebessert, nachdem sie Tysabri abgesetzt hat. Dennoch nimmt sie Mavenclad nicht. "Ich habe auch nach Gesprächen mit Experten zu viel Respekt und Angst vor der Einnahme."
- Gen-Therapie: Das ist das teuerste Medikament der Welt
- Zwei Millionen Euro: Das teuerste Medikament soll nach Deutschland kommen
- Multiple Sklerose: Ursachen, Symptome, Verlauf und Therapie
- Fisch statt Fleisch: Richtige Ernährung bei Multipler Sklerose: Worauf achten?
Ein Gespräch mit der MS-Stiftung Trier führte zum Meinungsumschwung. "Es sind einfach zu viele Risiken, die ich nicht abschätzen kann", so Sabine Schmidt. "Im Grunde genommen sind wir Versuchskaninchen." Sie hat sich deshalb dafür entscheiden, übergangsweise wieder auf das Medikament zurückzugehen, dass sie vor Tysabri genommen hatte.
Die Mittfünfzigerin hofft jetzt auf ein neues Medikament, das bald auf den Markt kommen soll, und bei dem sich wieder Fragen stellen werden. "Also weiterhin hoffen, bangen, sorgen und informieren! Ich hoffe, damit die richtige Entscheidung getroffen zu haben."
*Wir hatten an dieser Stelle geschrieben, der Expertenrat berate Patienten. Er berät Ärzte.
- Eigene Recherchen
- EMA: Movectro: Withdrawal of the marketing authorisation application
- Genetic Engineering & Biotechnological News: Merck Serono Gives Up on Getting Drug Candidate for Multiple Sclerosis Approved
- Reuters: Merck KGaA pulls plug on cladribine on FDA feedback
- DMSG: Patienteninformation Cladribin
- PR Newswire: Merck Serono: Update zur aktuellen regulatorischen Entwicklung für Cladribin-Tabletten
- neuology.org: No evidence for higher risk of cancer in patients with multiple sclerosis taking cladribine
- EMA: Movectro withdrawal letter
- EMA: Assessment-Report Mavenclad
- arznei-telegramm.de: Cladribin (Mavenclad) jetzt auch bei Multipler Sklerose
- dmsg.de: Erneuter Roter-Hand-Brief: Rückruf für Daclizumab in der Multiplen Sklerose-Therapie
- arznei-telegramm.de: MS-Mittel Daclizumab weltweit vom Markt
- EMA: Zusammenfassung der Merkmale des Medikaments Mavenclad
- correctiv.org: Euros für Ärzte
- Merck Group: Transparenzbericht über Zuwendungen an Wissenschaftler und Ärzte
- Merck Group: Transparenzbericht über Zuwendungen an Patientenorganisationen
- Handelsblatt: US-Zulassung von Mavenclad stärkt Merck
- Die Informationen ersetzen keine ärztliche Beratung und dürfen daher nicht zur Selbsttherapie verwendet werden.
Quellen anzeigen