Mehr als 150 Journalistinnen und Journalisten berichten rund um die Uhr für Sie über das Geschehen in Deutschland und der Welt.
Zum journalistischen Leitbild von t-online.Turbo-Zulassung Corona-Impfstoff: Wie kann Großbritannien so schnell sein?
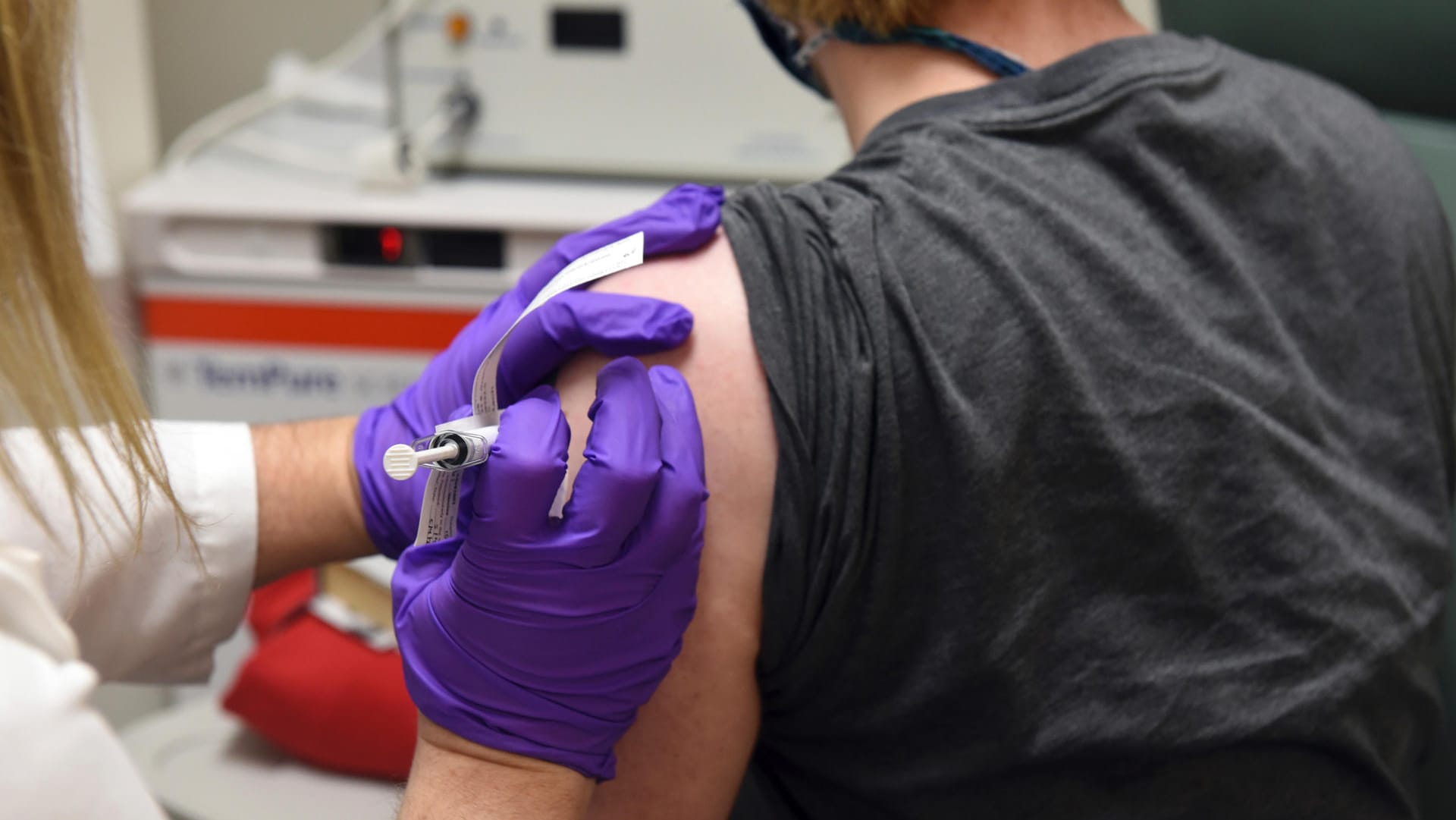

Als erstes Land hat Großbritannien den Corona-Impfstoff von Biontech und Pfizer zugelassen. Kritiker halten das für überhastet. Wann könnte es in der EU so weit sein?
Bereits in wenigen Tagen sollen die ersten Menschen in Großbritannien mit dem Corona-Impfstoff des Mainzer Unternehmens Biontech und seines US-Partners Pfizer geimpft werden. Die britische Aufsichtsbehörde erteilte dafür am 2. Dezember die Zulassung. Laut Premierminister Boris Johnson sollen zunächst Bewohner von Pflegeheimen, medizinisches Personal, alte und gesundheitlich gefährdete Menschen den Impfstoff erhalten.
Warum ging die Zulassung dort so schnell und wie lange dauert die Prüfung der europäischen Behörden noch?
Wie konnte Großbritannien so schnell sein?
Die schnellere Zulassung in Großbritannien sei durch den Brexit möglich gewesen, betonte der britische Gesundheitsminister Matt Hancock. "Wir waren in der Lage, eine Entscheidung zu treffen dank der britischen Aufsichtsbehörde, einer Weltklassebehörde, und mussten nicht das Tempo der Europäer gehen, die sich ein bisschen langsamer bewegen", sagte er dem Sender Times Radio. Die Sicherheitschecks seien alle durchgeführt und die gleichen Prozesse durchlaufen worden.
Gibt es Unterschiede beim Zulassungsprozess?
Die zuständige britische Aufsichtsbehörde Medicines & Healthcare Products Regulatory Agency (MHRA) wies darauf hin, die Zulassung sei nach EU-Bestimmungen getroffen worden, nach denen sich London bis zum Ende der Brexit-Übergangsphase weiter richten müsse. Doch laut einigen Experten sei dieses Verfahren in Großbritannien anders abgelaufen.
Zum Vergleich: Normalerweise dauert die Prüfung eines Arzneimittels – in diesem Fall eines Impfstoffes – ungefähr ein Jahr. Doch unter Pandemie-Bedingungen wurde das gesamte Verfahren beschleunigt. Warum aber ist die EU nicht so schnell?
In der Europäischen Union ist die Europäische Arzneimittel-Agentur – kurz Ema – für die Bewertung von Impfstoffkandidaten zuständig. Die Mitarbeiter der Behörde mit Sitz in Amsterdam, darunter Wissenschaftler verschiedener Länder, prüfen und beurteilen wochenlang die Daten des Impfstoffherstellers und stellen kritische Fragen. Schließlich muss der Impfstoff für sicher und wirksam befunden werden, bevor er dann von der EU-Kommission die Zulassung in allen Mitgliedstaaten erhält.
Im Unterschied zum Alleingang der MHRA in Großbritannien muss die Ema in der EU auch die Meinungen aller 27 EU-Länder einholen und eine gemeinsame Beschaffung des Impfstoffes vorbereiten. Die einzelnen Staaten wiederum müssen den Wirkstoff auch noch final prüfen, damit er ausgeliefert werden kann. Das alles kostet Zeit.
Noch länger dauert der Zulassungsprozess einem Bericht der "New York Times" zufolge oftmals in den USA. Die Regulierungsbehörden in Europa stützten sich stärker auf die eigenen Analysen der Unternehmen. Die US-Prüfer hingegen würden die Rohdaten der Studien sichten und die Zahlen selbst überprüfen.

Embed
Kritik von deutschem Politiker: "Überhastete Notfallzulassung"
CDU-Politiker Peter Liese, Arzt und Mitglied des Europäischen Parlaments, kritisierte das Vorgehen der Briten scharf. Dieses sei nicht zur Nachahmung empfohlen, heißt es in einer Pressemitteilung. Einige Wochen der gründlichen Prüfung durch die Europäische Arzneimittel-Agentur seien besser als eine überhastete Notfallzulassung, so Liese.
Er vermute hinter der Zulassung politische Gründe: Die Zulassung solle über politisches Versagen in der Corona-Krise hinwegtäuschen.

Wir benötigen Ihre Einwilligung, um den von unserer Redaktion eingebundenen X-Inhalt anzuzeigen. Sie können diesen (und damit auch alle weiteren X-Inhalte auf t-online.de) mit einem Klick anzeigen lassen und auch wieder deaktivieren.
Auf Twitter schreibt der Politiker außerdem, er sei mit der Ema-Chefin Emer Cooke im Austausch. Die Mitarbeiter der EU-Behörde würden "Tag und Nacht die Daten von Biontech analysieren, um eine Entscheidung zu treffen". Dies geschehe nach wissenschaftlichen Standards und ohne Abstriche bei der Sicherheit.
Großbritannien steht nun vor logistischen Herausforderungen
Doch auch wenn die Regierung in London die Impfstoffzulassung als Erfolgsmeldung feierte, dürfte sich die Durchführung der Impfungen als echte Herausforderung erweisen. Denn allein die Lagerung des Corona-Impfstoffs ist kompliziert. Er muss bei minus 70 Grad in Ultratiefkühlschränken aufbewahrt werden, sonst verliert der Wirkstoff nach wenigen Tagen seine Wirksamkeit.
Und erst nach einer zweiten Impfdosis entfaltet sich die Schutzwirkung des Vakzins. "Es wird unvermeidlich einige Monate dauern, bevor alle, die am meisten gefährdet sind, geschützt sind – lange, kalte Monate", sagte Boris Johnson.
Wann erfolgt die Zulassung in der EU?
Für die EU will die Europäische Arzneimittel-Agentur noch im Dezember über eine Zulassungsempfehlung für den Corona-Impfstoff von Biontech und Pfizer entscheiden. Bis 29. Dezember soll ein Ergebnis der Prüfung vorliegen, hieß es von der Ema.
"Da die derzeit geprüften Covid-Impfstoffe Millionen von Menschen in der EU verabreicht werden, sind wir uns der riesigen Verantwortung nur allzu bewusst, unsere Beurteilung und Empfehlungen korrekt zu erstellen, damit wir die europäische Bevölkerung schützen können", sagte Ema-Chefin Emer Cooke. Die wissenschaftliche Bewertung werde unabhängig erfolgen und allein von Sicherheit, Qualität und Wirksamkeit der Impfstoffe abhängen – "nichts sonst".
Das begrüßte auch Bundesgesundheitsminister Jens Spahn. Er sagte nach einer Konferenz mit seinen EU-Kollegen, es gehe bei den Impfstoffen nicht darum, "irgendwie Erster zu sein". Entscheidend sei, sichere und wirksame Impfstoffe zu bekommen.
- New York Times: "Why the U.K. Approved a Coronavirus Vaccine First", 2. Dezember 2020
- Twitter-Profil von Peter Liese
- Nachrichtenagentur dpa
- Eigene Recherche
- Die Informationen ersetzen keine ärztliche Beratung und dürfen daher nicht zur Selbsttherapie verwendet werden.
Quellen anzeigen